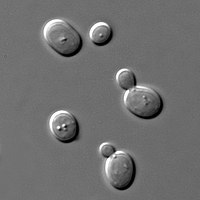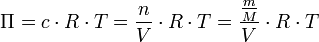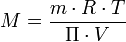
Esquema de una
membrana semipermeable. Las moléculas grandes de la
sangre no pueden atravesar la membrana, mientras que las pequeñas de disolvente sí.
La presión osmótica puede definirse como la presión que se debe aplicar a una solución para detener el flujo neto de disolvente a través de una membrana semipermeable.1 La presión osmótica es una de las cuatro propiedades coligativas de las soluciones (dependen del número de partículas en disolución, sin importar su naturaleza). Se trata de una de las características principales a tener en cuenta en las relaciones de los líquidos que constituyen el medio interno de los seres vivos, ya que la membrana plasmática regula la entrada y salida de soluto al medio extracelular que la rodea, ejerciendo de barrera de control.
Cuando dos soluciones se ponen en contacto a través de una membrana semipermeable (membrana que deja pasar las moléculas de disolvente pero no las de los solutos), las moléculas de disolvente se difunden, pasando habitualmente desde la solución con menor concentración de solutos a la de mayor concentración. Este fenómeno recibe el nombre deósmosis, palabra que deriva del griego osmos, que significa "impulso".2 Al suceder la ósmosis, se crea una diferencia de presión en ambos lados de la membrana semipermeable: la presión osmótica.
Presión osmótica de equilibrio

Esquema del modo de acción de la presión osmótica. En azul se representan las moléculas de
disolvente y en rojo las de
soluto. La disolución más concentrada se denomina
hipertónica y la diluida
hipotónica. Como consecuencia de la diferencia inicial de concentraciones se produce una presión osmótica, apareciendo una diferencia de altura h, hasta que las concentraciones se igualan.
Se considera que una disolución está en equilibrio cuando no existe intercambio neto de soluto entre las diferentes partes de la misma. Si la disolución se encuentra rodeada por una membrana, el equilibrio se alcanza cuando la presión exterior (generalmente la presión atmosférica) se iguala a la presión que el disolvente ejerce sobre la membrana. Ésta última es la presión osmótica, que se representa habitualmente mediante la letra griega Π.
Cuando se tiene una membrana semipermeable separando dos soluciones de distinta concentración (llamada hipertónica a la de mayor concentración e hipotónica la de menor), las moléculas de disolvente (agua por lo general) la atraviesan, pasando de la disolución menos concentrada a la más concentrada, diluyéndose ésta última cada vez más, hasta que las concentraciones se igualen. Si el volumen era inicialmente idéntico en las dos soluciones, ocurre que en la solución hipertónica el volumen aumenta, hasta que la presión hidrostática (que aumenta debido al incremento de altura h) iguale las presiones a ambos lados de la membrana. Esta presión hidrostática que detiene el flujo neto de disolvente es equivalente a la presión osmótica, y es el fundamento del osmómetro utilizado para su medición.
Teorías
Teoría de van 't Hoff

Las partículas de un
gas se mueven en todas direcciones y chocan entre ellas mismas y con las paredes del recipiente. Los choques contra las paredes representan la presión del gas. En esta animación el disolvente se representa con bolas azules y el soluto con bolas rojas.
Se han propuesto diversas teorías para explicar la causa de la ósmosis. La primera teoría fue la del bombardeo de van 't Hoff, que está basada en la analogía entre la ecuación de la presión osmótica y laley de los gases ideales. Van 't Hoff describió la presión osmótica como el resultado de las colisiones de las moléculas de soluto contra la membrana semipermeable, y supuso que las moléculas dedisolvente no contribuían de ninguna manera. Con este modelo, la presión osmótica de una disolución es la misma presión que un gas ideal ejercería si ocupase el mismo volumen de la disolución.
Otras teorías
La suposición en la teoría de van 't Hoff de que las moléculas del disolvente no ejercen ningún efecto sobre la presión osmótica constituye un interrogante, ya que estas partículas se encuentran golpeando continuamente la membrana semipermeable. De este problema surge otra teoría, que considera el bombardeo de las moléculas de disolvente; según esta teoría las moléculas de disolvente bombardean la membrana semipermeable de manera desigual y provocan la ósmosis y la presión osmótica, aunque la diferencia de presiones aumente con la cantidad de soluto.
Una tercera teoría explica la ósmosis en base al descenso de la presión de vapor, el cual da lugar a que el disolvente se difunda a través de la membrana hasta que se igualan las dos presiones. Si se aplica una presión igual a la presión osmótica de la disolución se saturará la destilación, y se necesitaría una presión mayor para invertir la dirección.6 9 El flujo de disolvente a través de una membrana semipermeable es análogo al flujo de disolvente en la fase vapor que se produce si se dejan, dentro de un recipiente cerrado, muestras del disolvente y de una disolución. Como la presión de vapor del disolvente es mayor, se produce una transferencia neta de disolvente hacia la disolución. El flujo de disolvente continúa hasta que todo el disolvente ha pasado a la disolución.10
Magnitud de la presión osmótica
La presión osmótica, como su nombre indica, es una presión, y por tanto tiene las mismas unidades que el resto de presiones, es decir,Pascales (Pa) en el Sistema Internacional, aunque tradicionalmente también se utilizan las atmósferas (atm).
La molaridad mide la cantidad de masa del soluto por volumen de disolución. La molaridad y la presión osmótica son dos magnitudes relacionadas proporcionalmente; el aumento o disminución de una de ellas produce el mismo efecto en la otra, aunque en distinta proporción. Del mismo modo, la temperatura (medida en kelvin, K) también posee la misma relación con la presión osmótica.
A continuación se muestra una tabla con los valores de la presión osmótica correspondientes a diferentes concentraciones de sacarosa a una temperatura constante de 293 K (20 °C). La concentración se expresa en molalidad y no en molaridad, según la ecuación de Morse, pero las diferencias son mínimas.
| Presión osmótica experimental de disoluciones de sacarosa a 20 °C11 |
| Molalidad (g sacarosa/kg agua) | 0,1 | 1,0 | 2,0 | 3,0 | 4,0 | 6,0 |
|---|
| Presión osmótica (atm) | 2,47 | 27,2 | 58,4 | 95,2 | 139,0 | 232,3 |
|---|
Comparación entre presión osmótica y presión hidrostática
Al tratarse ambas de presiones, se puede comparar el valor de la presión osmótica con el de la presión hidrostática en determinadas situaciones. La presión hidrostática viene dada por:

donde ρ es la densidad del líquido (para agua: ρagua = 1 000 kg/m3), g es la aceleración de la gravedad (en la superficie terrestre: g = 9,81 m/s2), y h es la profundidad, expresada en metros.
Con esta fórmula, se puede comparar a qué profundidad de agua correspondería cualquier valor de la presión osmótica de la tabla anterior. Por ejemplo, a molalidad 1 gsac/kgagua corresponde una presión de 27,2 atm. De este modo, despejando h:

Y convirtiendo atmósferas a pascales (27,2 atm 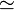 2 750 000 Pa), obtenemos finalmente la altura:
2 750 000 Pa), obtenemos finalmente la altura:

Así, la presión osmótica sobre la membrana semipermeable que ejerce la disolución de un gramo de sacarosa en un kilogramo de agua equivale a la presión a 281 m bajo el agua, un valor realmente elevado.
Relación entre presión osmótica y entropía
Desde el punto de vista de la termodinámica, se puede relacionar la presión osmótica con la entropía para explicar el sentido de flujo del disolvente. El paso de disolvente hacia la disolución representa un aumento de entropía del sistema. Las moléculas de soluto aumentan su desorden al diluir la disolución mezclándose con el disolvente que atraviesa la membrana, ya que las moléculas de soluto tienen más espacio para moverse, lo que representa un mayor número de posiciones disponibles (mayor desorden), y, por tanto, una mayor entropía. También las moléculas de disolvente tienen mayor desorden en una disolución que en estado puro. Si el disolvente pasase desde la disolución al disolvente puro el orden aumentaría, lo cual disminuiría la entropía y no se cumpliría el segundo principio de la termodinámica. Todo esto demostrable matemáticamente.10
Relaciones con otras magnitudes físicas y químicas
Disoluciones diluidas de no electrolitos
En el caso de disoluciones diluidas de no electrolitos se aplica directamente la ecuación de van 't Hoff. Si la presión osmótica se produce entre dos disoluciones, en lugar de entre una disolución y el disolvente puro, en la ecuación figura la diferencia de concentraciones, ΔC:

Sin embargo, la ecuación obtenida por el químico norteamericano Harmon Northrop Morse se ajusta mejor a las observaciones experimentales. Morse sustituyó la concentración expresada en molaridad de la ecuación de van 't Hoff, por la expresada en molalidad, m.12 Así, la ecuación de Morse queda como sigue:

Realmente, la ecuación de Morse expresada en molalidad solamente es correcta si el disolvente es agua, ya que el volumen de agua expresado en litros coincide con su masa expresada en kilogramos.
| [mostrar]Deducción termodinámica de las ecuaciones de Morse y van 't Hoff 13 |
|---|
Disoluciones diluidas de electrolitos
Jacobus Henricus van 't Hoff descubrió que las disoluciones de electrolitos no cumplían la ecuación de la presión osmótica para disoluciones de no electrolitos, e introdujo el llamado factor de van 't Hoff, un factor determinado empíricamente simbolizado por la letra  , y definido como el cociente entre el valor experimental de la presión osmótica media y el valor teórico que se deduce con la ecuación para disoluciones de no electrolitos:
, y definido como el cociente entre el valor experimental de la presión osmótica media y el valor teórico que se deduce con la ecuación para disoluciones de no electrolitos:

De esta manera la nueva ecuación para la presión osmótica queda de la siguiente forma:

Este factor de corrección fue explicado por el químico sueco Svante August Arrhenius, quien entre 1883 y 1887 desarrolló la teoría de la disociación electrolítica,14 según la cual las moléculas de los electrolitos se disocian en mayor o menor medida en iones cargados eléctricamente, capaces de transportar la corriente eléctrica, y existiendo un equilibrio entre las moléculas no disociadas y los iones. Por tanto, en disolución hay más partículas que las que se han disuelto ya que estas se rompen, se disocian, en partes más pequeñas. La presión osmótica, como las otras propiedades coligativas, depende del número total de partículas en disolución, de manera que en una disolución de electrolitos se tendrán más partículas que las disueltas, las cuales se han de tener en cuenta para calcular la concentración total. A modo de ejemplo, podemos suponer un electrolito binario como el cloruro de calcio, CaCl2, el cual alcanza el equilibrio de disociación en agua según la siguiente ecuación:

Por tanto, en disolución, hay más partículas que las disueltas inicialmente porque parte de estas partículas se han disociado en iones.13
Disoluciones reales
Para disoluciones concentradas, se ha de utilizar la actividad (más concretamente su logaritmo,  ) en lugar de las fracciones molares, y se debe tener en cuenta la influencia de la presión en el volumen molar del disolvente (en la deducción termodinámica se considera el volumen de disolvente constante). De esta manera se obtiene una expresión más precisa, aplicable a las disoluciones concentradas que contienen un término añadido donde aparece la presión osmótica al cuadrado:
) en lugar de las fracciones molares, y se debe tener en cuenta la influencia de la presión en el volumen molar del disolvente (en la deducción termodinámica se considera el volumen de disolvente constante). De esta manera se obtiene una expresión más precisa, aplicable a las disoluciones concentradas que contienen un término añadido donde aparece la presión osmótica al cuadrado:

donde 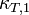 es el coeficiente de compresibilidad isotermo del disolvente.13
es el coeficiente de compresibilidad isotermo del disolvente.13
| [mostrar]Deducción termodinámica de la ley de la presión osmótica para disoluciones reales 13 |
|---|
En el caso de electrolitos, el coeficiente de actividad del disolvente permanece cercano a la unidad, aunque la concentración de electrolitos sea alta, y por tanto, con coeficientes de actividad del electrolito alejados de la unidad. Por este motivo, el coeficiente de actividad del disolvente no resulta adecuado para caracterizar las propiedades reales de la disolución electrolítica concentrada y se define el coeficiente osmótico (φx), por parte del químico danés Niels J. Bjerrum, de la siguiente manera:

Así, la expresión de la presión osmótica para electrolitos queda corregida con el coeficiente osmótico:13

La presión osmótica en la naturaleza
La presión osmótica en el medio interno

Difusión de agua en las células vegetales por efecto de la presión osmótica.

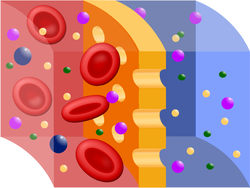
Eritrocitos dentro de disoluciones con distinta concentración.
La ósmosis tiene una gran importancia en los seres vivos. Las células de los organismos están rodeadas por fluidos acuosos, como la sangre, la linfa, o la savia, que contienen concentraciones de diferentes solutos. Las membranas celulares son permeables al agua, al oxígeno, al nitrógeno, al dióxido de carbono, y a otras moléculas orgánicas de pequeño tamaño, como glucosa o aminoácidos, mientras que son impermeables a las moléculas poliméricas, como proteínas y polisacáridos. En cambio, los iones inorgánicos y los disacáridos, como la sacarosa, pasan muy lentamente a través de las membranas celulares.
Las células también tienen la capacidad de transportar especies químicas a través de su membrana desde una región de baja concentración de la especie a una región de concentración más elevada, en sentido contrario al del flujo espontáneo. Los mecanismos que originan este tipo de transporte, denominado transporte activo, son complejos y todavía no se conocen totalmente. Un ejemplo típico de transporte activo es el de cationes potasio, K+, hacia el interior de las células desde los líquidos circundantes, que tienen menor concentración de cationes potasio.
En ausencia de transporte activo, la membrana celular permite el paso de moléculas de agua y de todos los solutos permeables hasta que se igualen sus respectivospotenciales químicos a ambos lados de la membrana. No obstante, existe un gran número de especies, tanto en el fluido que rodea la célula como en el fluido celular ocitoplasma, que no pueden atravesar la membrana. Si la concentración total de este soluto es más grande en el fluido que rodea la célula, esta perderá agua por ósmosis, y se dice que el fluido circundante es hipertónico respecto al fluido celular (tiene mayor presión osmótica). En caso contrario, cuando la concentración total del soluto que no puede atravesar la membrana es mayor en el fluido de la célula, esta ganará agua del líquido hipotónicocircundante (de menor presión osmótica). Cuando no se produce transferencia neta de agua entre el fluido celular y el que rodea la célula, se dice que los dos fluidos son isotónicos, es decir, tienen la misma presión osmótica. La sangre y la linfa son aproximadamente isotónicos respecto de las células de un organismo.
Los líquidos de las inyecciones contienen una disolución salina isotónica con la sangre, porque si se inyectara agua directamente, loseritrocitos de la sangre la absorberían por ósmosis hasta estallar.7
Osmorreceptores
Existen unas células especializadas en detectar cambios de la presión osmótica en los líquidos corporales (plasma sanguíneo, fluido intercelular...), llamadas osmorreceptores. Los osmorreceptores pueden localizarse en algunas estructuras, como en el hipotálamo, en lasarterias, entre otros lugares. Mediante estas células, el organismo puede regular la concentración de sales en sus fluidos, la osmolalidad.15 En los seres humanos, son osmorreceptores los núcleos supraóptico o paraventricular. Por medio de las hormonas antidiuréticas (también llamada vasopresina, ADH o pitresina), los osmorreceptores inhiben ladiuresis con tal de mantener la presión osmótica de la sangre correspondiente a una osmolalidad media de 285 osmol/kg. Es suficiente una variación de tan sólo 3 osmol/kg para activar este mecanismo.16
La absorción de agua en los vegetales

Semillas germinadas con la radícula llena de pelos absorbentes.
Los vegetales utilizan la presión osmótica para hacer ascender agua a través del xilema desde las raíces hasta las hojas. Así se ha comprobado en los arces al comenzar la primavera y se inicia el movimiento de la savia. Las raíces tienen una gran concentración de azúcaresalmacenados, producidos durante el verano. Cuando se funde la nieve, el agua llega en grandes cantidades a las raíces y entra dentro de ellas a través de pelos absorbentes, y por efecto de la presión osmótica la savia sube hacia las hojas. Sin embargo, en la mayoría de los vegetales no es posible explicar la ascensión de la savia hasta las hojas por medio de la presión osmótica. En las partes más elevadas del vegetal, la savia asciende debido al descenso de presión provocado por la transpiración de las hojas. En ocasiones, en lugar de que las raíces presenten grandes concentraciones de azúcares, se encuentran rodeadas de agua muy salada, produciéndose el fenómeno conocido como ósmosis inversa; este es el caso de losmangles.17
Organismos osmófilos
Se denominan osmófilos los organismos extremófilos que pueden crecer en ambientes con una alta concentración de azúcares.15 Casi todos los microorganismos osmófilos son levaduras. Los osmófilos son similares a los organismos halófilos (medios salinos). La alta concentración de azúcar representa un factor limitante en el crecimiento de muchos microorganismos, pero los osmófilos logran protegerse contra la elevada presión osmótica por medio de la síntesis de osmoprotectores, como alcoholes yaminoácidos. Estos organismos son importantes porque causan el deterioro de productos como loszumos de frutas, los jarabes o la miel, además de tener aplicaciones industriales como la fermentaciónde la cerveza. Algunos ejemplos de este tipo de microorganismos osmófilos son: Saccharomyces rouxii, Saccharomyces bailii, Debaryomyces, y Saccharomyces cerevisiae, la levadura de la cerveza."Saccharomyces" deriva del griego, que significa "moho del azúcar".
Aplicaciones
Científicas
Una de las aplicaciones científicas de la presión osmótica es la determinación de masas moleculares o masas molares, de macromoléculas. A partir de la ecuación de van 't Hoff se puede despejar la masa molar, M, del soluto disuelto:
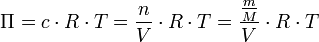
Despejando la masa molar, ésta queda en función de constantes y variables que se pueden medir en el laboratorio: la masa disuelta de soluto, la constante de los gases ideales, R, la temperatura absoluta, T, el volumen de disolución, V, y la presión osmótica, Π:
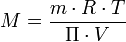
Analíticas
En los laboratorios se puede determinar la concentración total de partículas en disolución osmóticamente activas, lo que se conoce comoosmolaridad u osmolalidad, midiendo la presión osmótica. Los aparatos que se utilizan se denominan osmómetros de membrana. Se trata de aparatos automatizados que permiten la realización de las determinaciones de presión osmótica de forma rápida.
Industriales
En la industria se emplea la ósmosis inversa. Se trata de un procedimiento que invierte la difusión normal de disolvente desde la disolución diluida hacia la disolución concentrada, aplicando una presión sobre la disolución concentrada que supera a la presión osmótica, permitiendo el paso de disolvente desde la disolución concentrada a la diluida.
Los campos de aplicación de la ósmosis inversa son cada vez más numerosos. Las áreas de laingeniería que más se han visto beneficiadas con estas aplicaciones son principalmente las industrias de los alimentos, del papel, la biomedicina, la petroquímica, la nuclear y, entre otras, la de separación o purificación de gases, donde se obtiene hidrógeno de la disociación del amonio, sulfuro de hidrógenodel gas natural de las refinerías, helio del gas natural, así como el enriquecimiento de oxígeno a partir del aire. También cabe destacar la recuperación de sustancias valiosas en fluidos de deshechos industriales. No obstante, la aplicación más importante es la desalinización del agua salada marina para su potabilización, lo cual ha permitido abastecer con agua de calidad a poblaciones situadas en lugares donde los recursos hidráulicos son insuficientes.
 . Mi sería la masa molecular del compuesto correspondiente y ξ se denomina grado de avance. Este concepto es importante pues es el único grado de libertad en la reacción.
. Mi sería la masa molecular del compuesto correspondiente y ξ se denomina grado de avance. Este concepto es importante pues es el único grado de libertad en la reacción.
![\sum_{i=1}^{N}{\nu_i[C_i]}=0](http://upload.wikimedia.org/math/b/1/f/b1f68dde512d50f6aeff6354bf05b8e7.png)












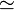 2 750 000 Pa), obtenemos finalmente la altura:
2 750 000 Pa), obtenemos finalmente la altura:


 , y definido como el cociente entre el valor experimental de la presión osmótica media y el valor teórico que se deduce con la ecuación para disoluciones de no electrolitos:
, y definido como el cociente entre el valor experimental de la presión osmótica media y el valor teórico que se deduce con la ecuación para disoluciones de no electrolitos:


 ) en lugar de las
) en lugar de las 
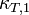 es el
es el